-
首頁
-
關(guān)于騰瑞
關(guān)于騰瑞
上海騰瑞制藥股份有限公司成立于2010年,是上海市高新技術(shù)企業(yè),騰瑞制藥以生物藥為主,涵蓋化學(xué)原料藥、口服固體制劑,是一家集藥品研發(fā)、生產(chǎn)、營(yíng)銷為一體的全產(chǎn)業(yè)鏈高新技術(shù)生物制藥企業(yè)。

上海騰瑞制藥奉賢生產(chǎn)基地位于上海自貿(mào)區(qū)臨港新片區(qū),坐落于上海市奉賢區(qū)四團(tuán)鎮(zhèn),整個(gè)廠區(qū)占地近100畝,是嚴(yán)格按國(guó)家GMP要求建設(shè)的綜合型制藥基地。擁有國(guó)家藥品批準(zhǔn)文號(hào)33個(gè),其中1個(gè)為國(guó)家一類生物制劑,已獲得11項(xiàng)全球及國(guó)家發(fā)明專利授權(quán)。
-
騰瑞產(chǎn)品
騰瑞產(chǎn)品
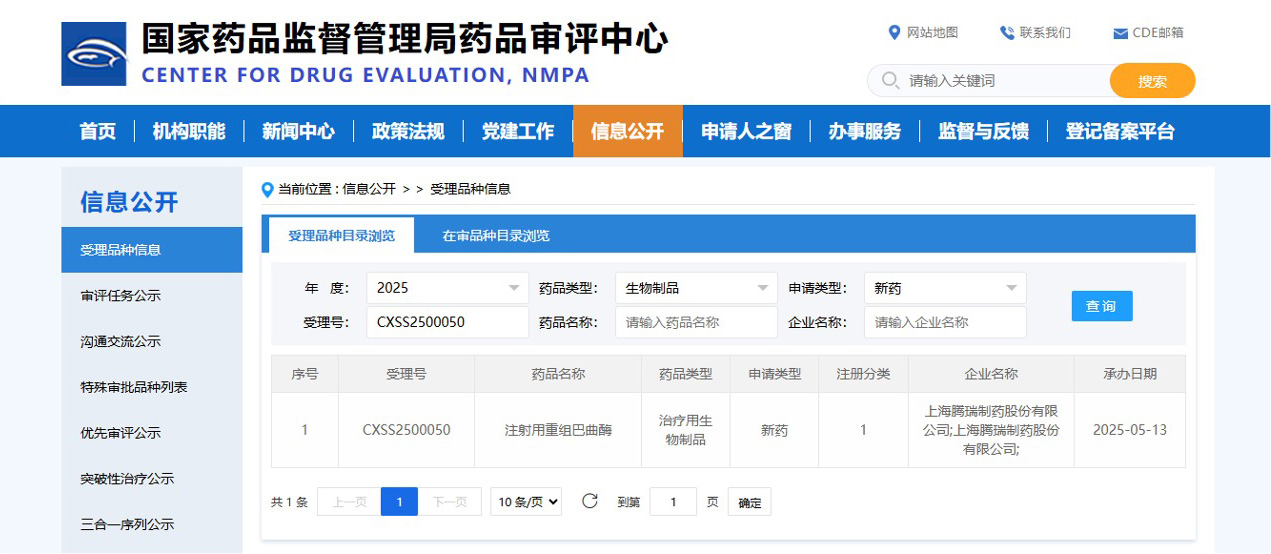
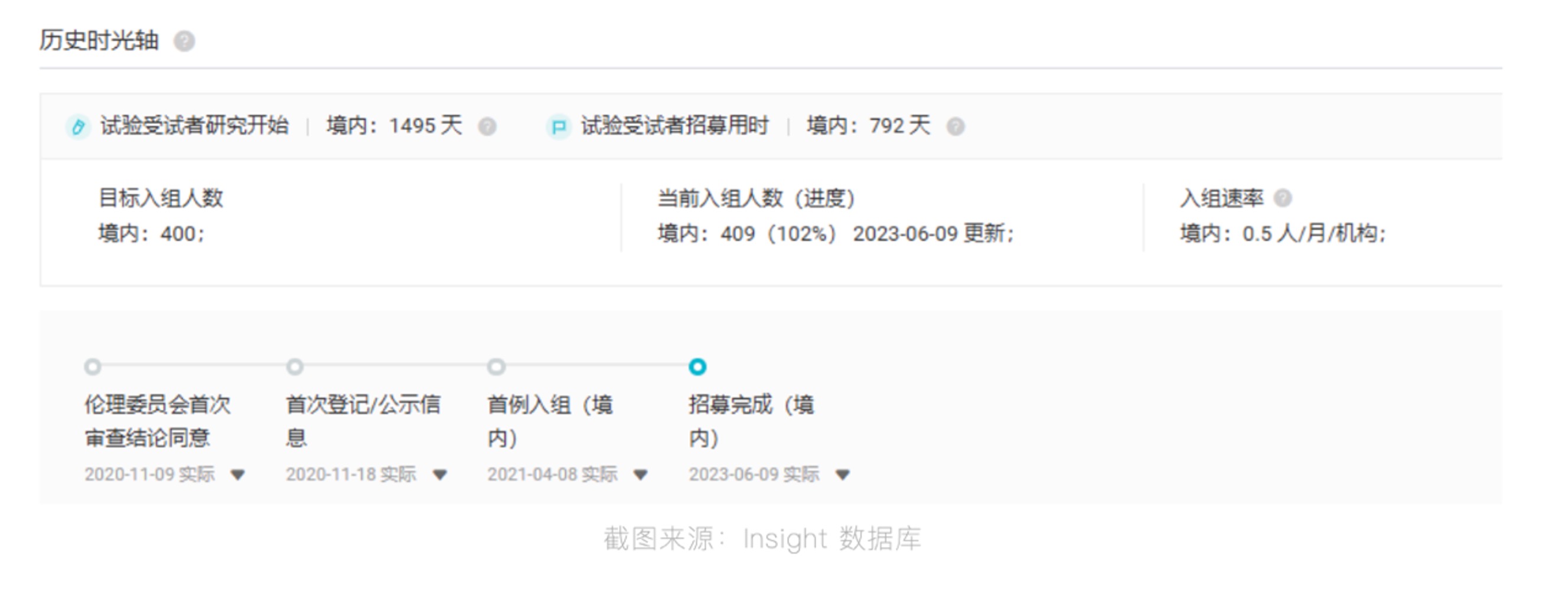
騰瑞制藥擁有國(guó)家一類生物新藥“外用重組人酸性成纖維細(xì)胞生長(zhǎng)因子 ”以及全球領(lǐng)先重組血凝酶制劑 “注射用重組巴曲酶”.

騰瑞制藥擁有國(guó)家一類生物新藥“外用重組人酸性成纖維細(xì)胞生長(zhǎng)因子”(商品名為艾夫吉夫 ) ,可以有效促進(jìn)傷口愈合,是中國(guó)原研、全球領(lǐng)先上市的國(guó)家醫(yī)保乙類產(chǎn)品。艾夫吉夫(AFGF)曾獲得原研專利、國(guó)家技術(shù)發(fā)明二等獎(jiǎng)、國(guó)家一類新藥、中華醫(yī)學(xué)會(huì)科技一等獎(jiǎng)等榮譽(yù)。
-
研發(fā)與科學(xué)
-
新聞動(dòng)態(tài)
新聞動(dòng)態(tài)
敢于擔(dān)當(dāng)、誠(chéng)信為本、努力拼搏的騰瑞,通過合作和發(fā)展共贏,贏得了用戶的長(zhǎng)期信賴,獲得了行業(yè)的高度認(rèn)可。

騰瑞制藥以“致力人類健康,共筑美好生活”為使命,夯實(shí)主業(yè)、開拓進(jìn)取,發(fā)展成為專業(yè)、創(chuàng)新的生物制藥企業(yè).
-
加入騰瑞
加入騰瑞
騰瑞制藥已建立標(biāo)準(zhǔn)的職位體系,明確職位職責(zé),準(zhǔn)確匹配工作資源,積極賦予優(yōu)秀人才價(jià)值.“坦誠(chéng)、包容、擔(dān)當(dāng)、創(chuàng)新”,成為每一位騰瑞人的精神標(biāo)桿.

優(yōu)秀的人才是騰瑞制藥發(fā)展的基石,為各類型人才提供平臺(tái),打通晉升通道及規(guī)劃發(fā)展路徑,激發(fā)積極性,是對(duì)每一位騰瑞人真正的關(guān)注和關(guān)懷.騰瑞制藥誠(chéng)邀您的加入!
-
聯(lián)系我們